Por Juarez Antonio de Sousa, mastologista, professor da FM/UFG
A Ultrassonografia consiste no emprego do ultrassom, modo B, utilizando transdutor linear com frequência acima de 7,5 MHz. É o método de imagem, não invasivo, mais utilizado como adjuvante na avaliação das doenças mamárias e não contém radiação ionizante. Tem baixo custo, ampla disponibilidade, e permite exame em tempo real para orientação dos procedimentos percutâneos. É um exame operador dependente e necessita de um médico experiente e conhecedor da anatomia e patologia mamária. Tem menor sensibilidade nas mamas adiposas, sendo limitado na avaliação de microcalcificações.
A ultrassonografia é indicada para avaliação de pacientes sintomáticas, sendo o exame de escolha para as mulheres abaixo de 35 anos. É fundamental na elucidação de achados inconclusivos detectados durante o rastreamento mamográfico, avaliação de implantes de silicone, mamas densas, pac ientes de alto risco, acompanhamento de pacientes operadas e orientação de procedimentos percutâneos. Os implantes de silicone rotos podem apresentar dois sinais ultrassonográficos: sinal da “tempestade de neve” quando a rotura for extracapsular (Figura 1), e sinal da “escada” ou “escadinha” quando a rotura for intracapsular.
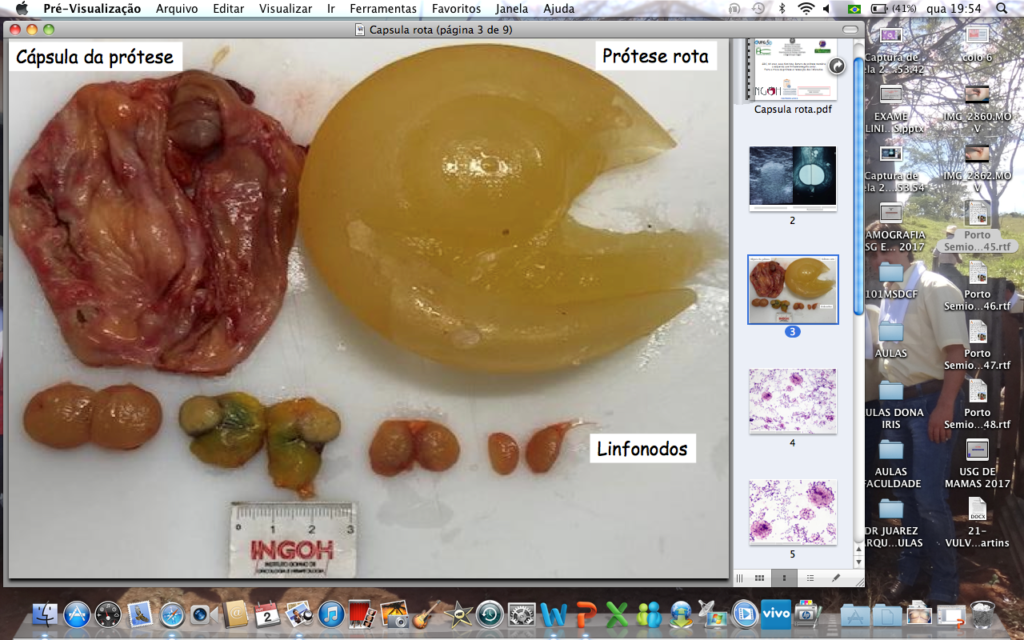
. A. Implante de silicone roto. Cápsula da prótese e linfonodos axilares acometidos por silicone.
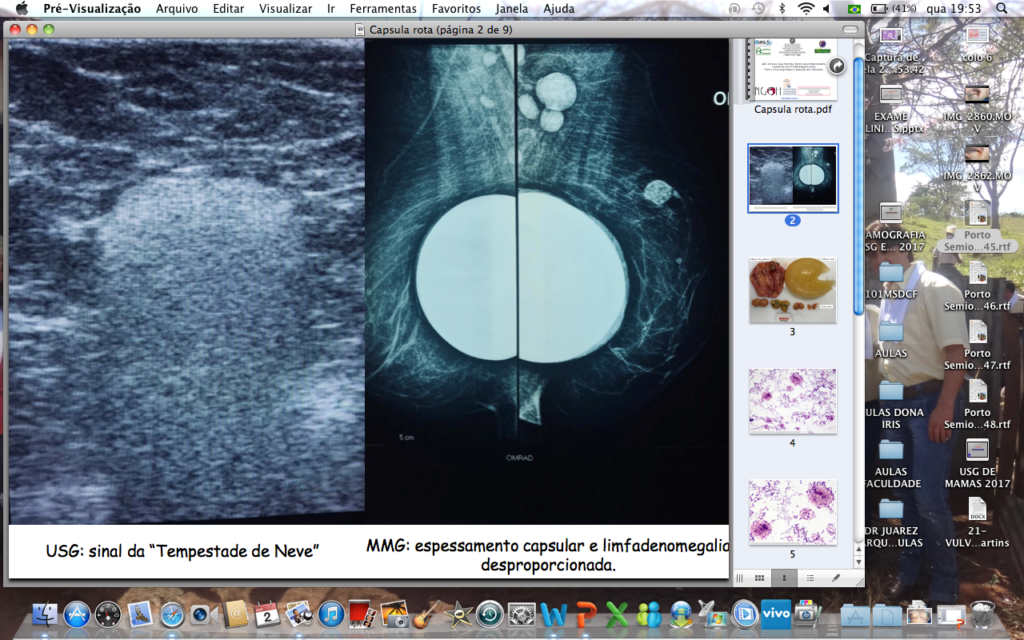
B. Ultrassonografia de mamas evidenciando sinal da “tempestade de neve”. Mamografia apresentando silicone roto à esquerda com migração do gel para os linfonodos do prolongamento axilar.
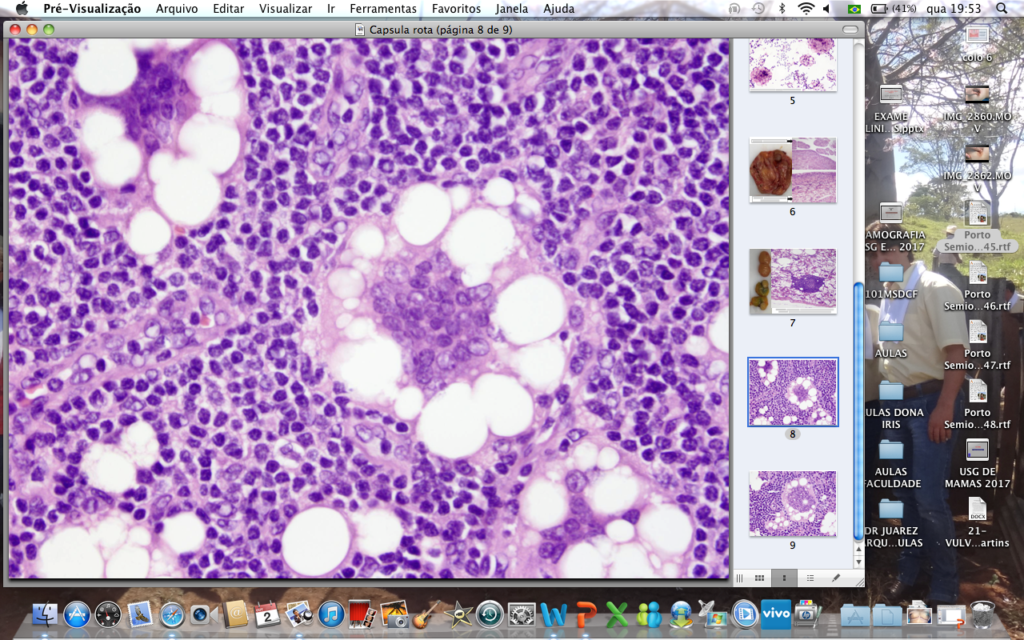
C. Microscopia mostrando linfonodo axilar acometido por gel de silicone. Coloração pelo HE.
Os achados principais são os nódulos sólidos, cistos (Figura 2), calcificações grandes, alterações ductais, distorção arquitetural, alterações de pele, linfonodos intramamários e axilares, corpo estranho (clipes metálicos, fios de sutura, cateteres e implantes de silicone), coleções líquidas e alterações pós-cirúrgicas. Os nódulos são descritos de acordo com a forma, margem, orientação, padrão de ecogenicidade, aspecto acústico posterior e relações sobre o tecido adjacente (Figuras 3 e 4). O laudo deve seguir a padronização do sistema BI-RADS®.
A 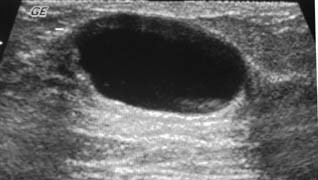
B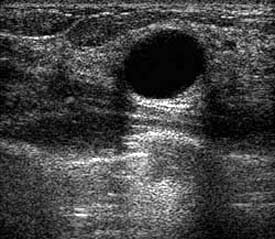
Figura 2. BI-RADS 2. A e B. Ultrassonografia de mamas evidenciando cistos simples. Padrão anecóico e reforço acústico posterior.
A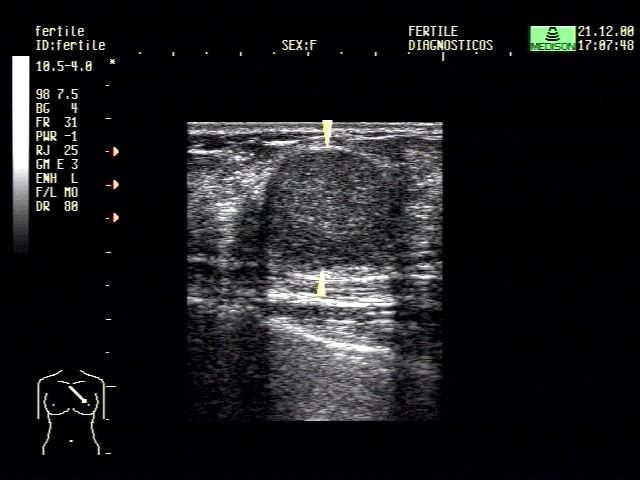
B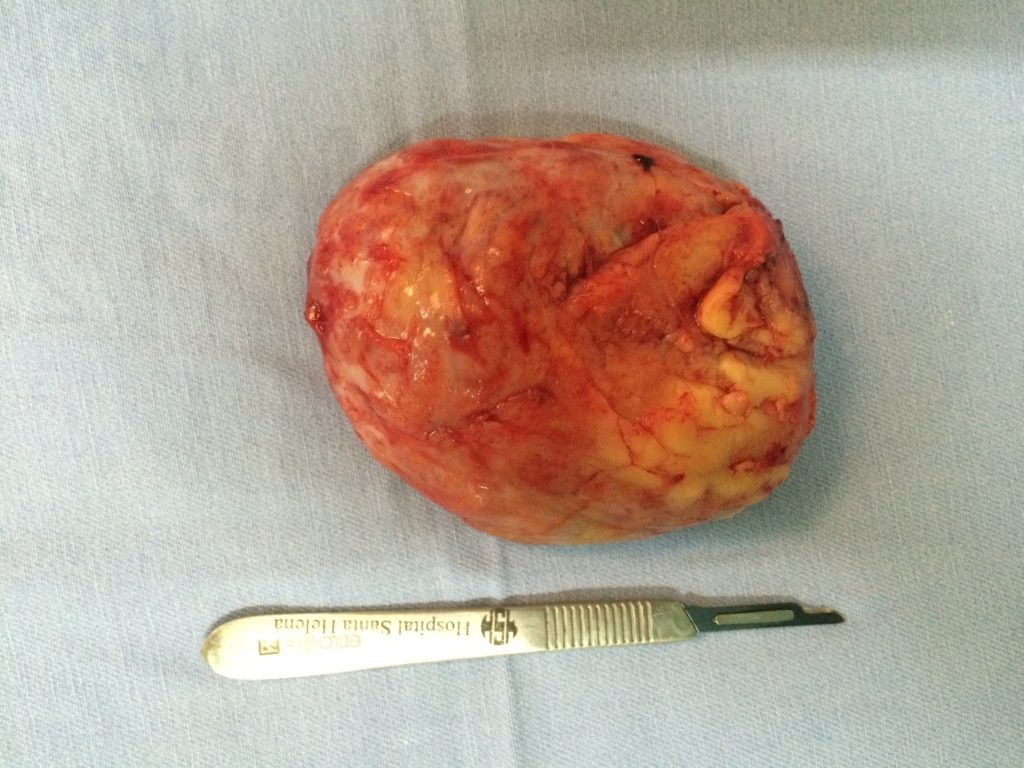
Figura 3. BI-RADS 3. Ultrassonografia de mamas. A. Nódulo sólido com padrão hipoecóico, e reforço acústico posterior. B. Peça cirúrgica (fibroadenoma).
A 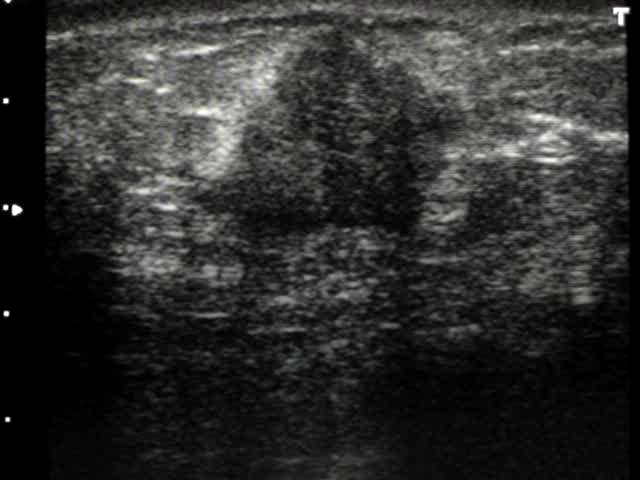
B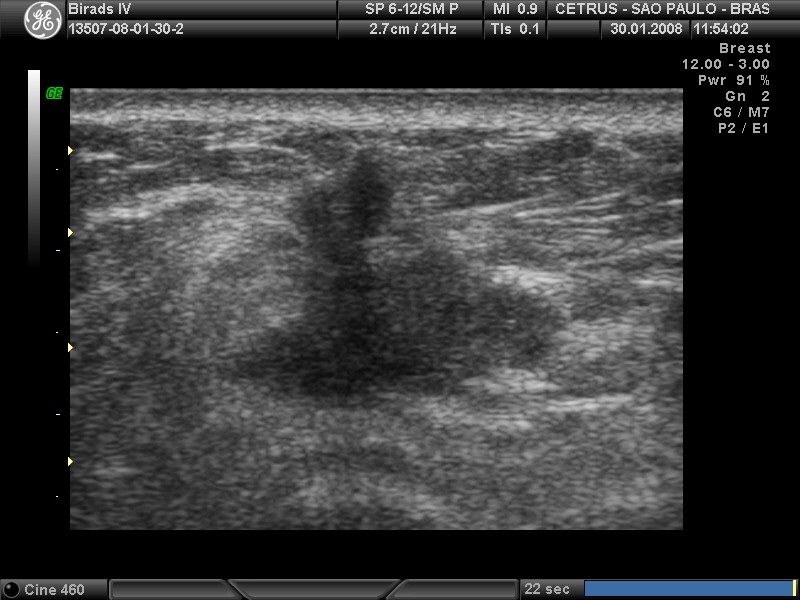
Figura 4. BI-RADS 5 (câncer de mama). A e B. Ultrassonografia de mamas apresentando nódulos suspeitos, de forma irregular, margens indistintas e orientação vertical.
Um dado adicional na avaliação ecográfica é a Elastografia que analisa o endurecimento como característica de nódulos e tecidos circunjacentes, obtido por meio de tensão do nódulo (compressão) ou por aplicação de energia ultrassônica. A dopplerfluxometria ainda apresenta resultados de estudos de acurácia ainda divergentes, dificultando sua incorporação na prática clínica. A ultrassonografia automatizada é uma nova tecnologia promissora que pode ser útil no rastreio do câncer em mulheres com tecido mamário denso.
PAAF – Punção aspirativa por agulha fina
A PAAF – punção aspirativa por agulha fina possibilita o diagnóstico citológico da lesão. É um método simples, de baixo custo e realizado em ambiente ambulatorial. A PAAF pode ser realizada sem auxílio de métodos de imagem (a mão livre), quando a lesão for palpável ou guiada por ultrassonografia, mamografia (estereotaxia) ou ressonância, quando a lesão não for palpável (Figura 5)
Figura 5. Punção aspirativa por agulha fina.
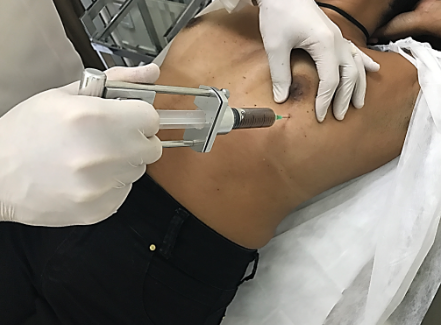
A. Mão Livre.
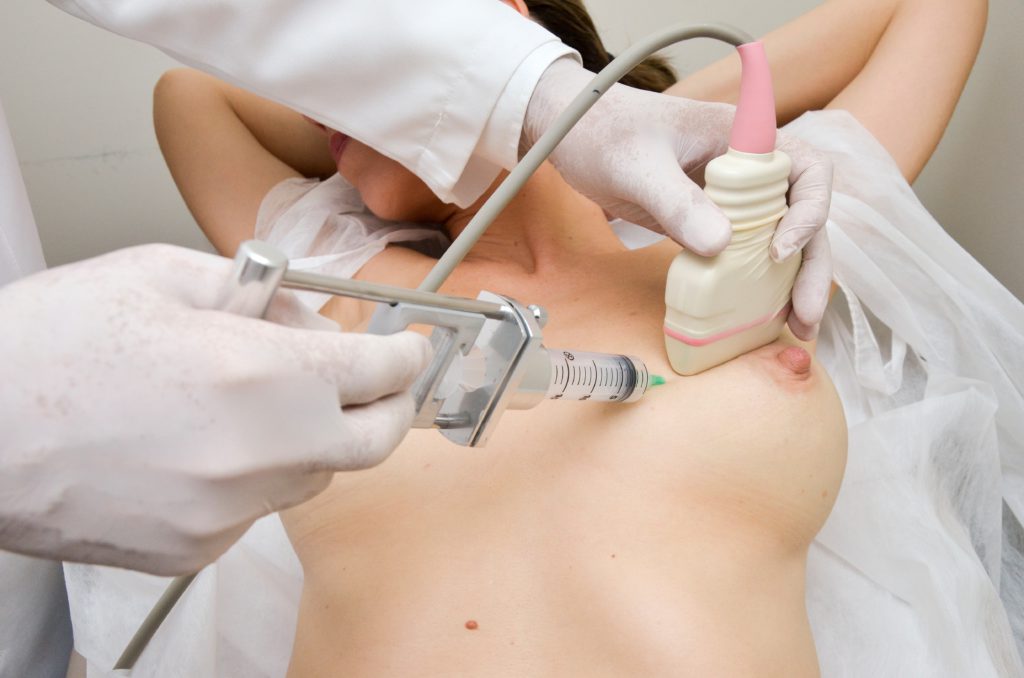
B. Guiada pela ultrassonografia.
Para realização do método, utiliza-se antissepsia e anestesia local com lidocaína 2%, um citoaspirador, onde se acopla uma seringa de 10 ou 20 ml, com agulha de fino calibre. Dá-se preferência para as agulhas mais longas, de 30 mm e fino calibre, que podem ser de 0,6 (azul), 0,7 (preta) ou 0,8 mm (verde). Reserva-se as agulhas de maior calibre, como por exemplo 40 x 12 (rosa) ou 40 x 15 mm (branca) para punções de lesões de conteúdo denso (espesso), grandes seromas e abscessos. Para a anestesia, utiliza-se agulhas, semelhantes às insulínicas, de 13 x 0,45 mm. O transdutor deve ser protegido com preservativo pela possibilidade de contaminação por sangue e outras secreções (Figura 6).
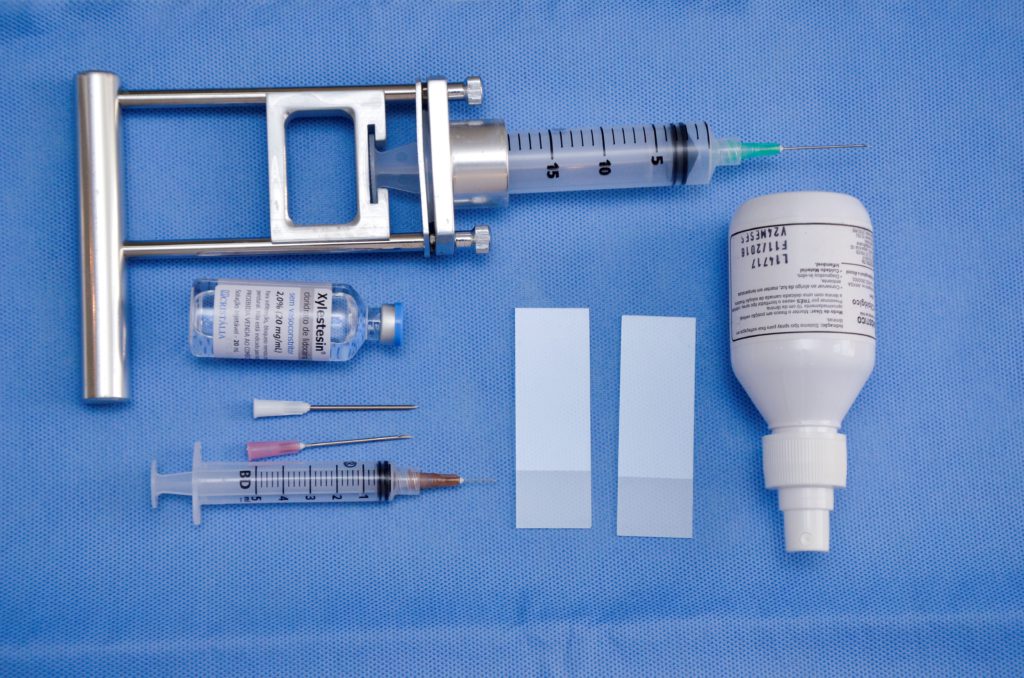
Figura 6. Punção aspirativa por agulha fina. Citoaspirador acoplado a uma seringa de 20 ml, agulha 30 x 0,8 mm. Seringa de 5 ml e agulha 13 x 0,45 mm para anestesia local. Lâminas e fixador. Agulhas de maior calibre, 40 x 12 (rosa) e 40 x 15 mm (branca) para punções de lesões de conteúdo denso (espesso), grandes seromas e abscessos.
O material aspirado é preparado em lâminas por esfregaço fino. A fixação pode ser feita em álcool absoluto (96º) ou citofixadores, quando a coloração for pelo método de Papanicolaou ou Hematoxilina-Eosina (HE), ou esfregaços secos ao ar, sem nenhuma fixação, quando empregada outra coloração especial, como, por exemplo, Giemsa, Panótico Rápido® ou Diff-Quik®. Outra opção seria a citologia em base líquida que é processada e homogeneizada em sistemas específicos, com enriquecimento celular, melhorando a visualização em fundo limpo. São confeccionadas lâminas que serão coradas posteriormente pelos métodos já citados.
A PAAF pode ser indicada em cistos, nódulos sólidos benignos e suspeitos, lesões complexas sólido-císticas, linfonodos axilares e seromas pós-cirúrgicos.
A citologia do derrame papilar deve ser solicitada e interpretada com cautela, somente em alguns casos selecionados, pelo baixo valor preditivo positivo do método, com índices de falso negativo em torno de 50%.
Biópsia por agulha grossa
A biópsia por agulha grossa permite o estudo histológico da lesão. É simples e confortável, amplamente disponível e ambulatorial. Pode ser orientada por ultrassonografia, mamografia ou ressonância magnética ou à mão livre quando a lesão for palpável. Também conhecida como biópsia de fragmento, tru-cut ou core biopsy, sendo mais barata que a mamotomia e cirurgia. Utiliza-se um dispositivo ou pistola acionado com molas que propulsionam a agulha através da lesão. A agulha, que é descartável, tem em média 12 cm e calibre 14 G (Figura 7 e 8). São obtidos de 3 a 5 fragmentos, sob anestesia local com lidocaína a 2%, e fixados em formol, que posteriormente serão processados e corados pela Hematoxilina-Eosina (HE). A mamotomia (biópsia vácuo-assistida) pode ser feita guiada por ultrassonografia, mamografia e ressonância magnética. Utiliza-se mesa adequada e tem a vantagem de retirar fragmentos maiores em tamanho e em quantidade. No entanto, exige equipamento apropriado e custo operacional maior que a core biopsy. Sua melhor indicação são as microcalcificações suspeitas
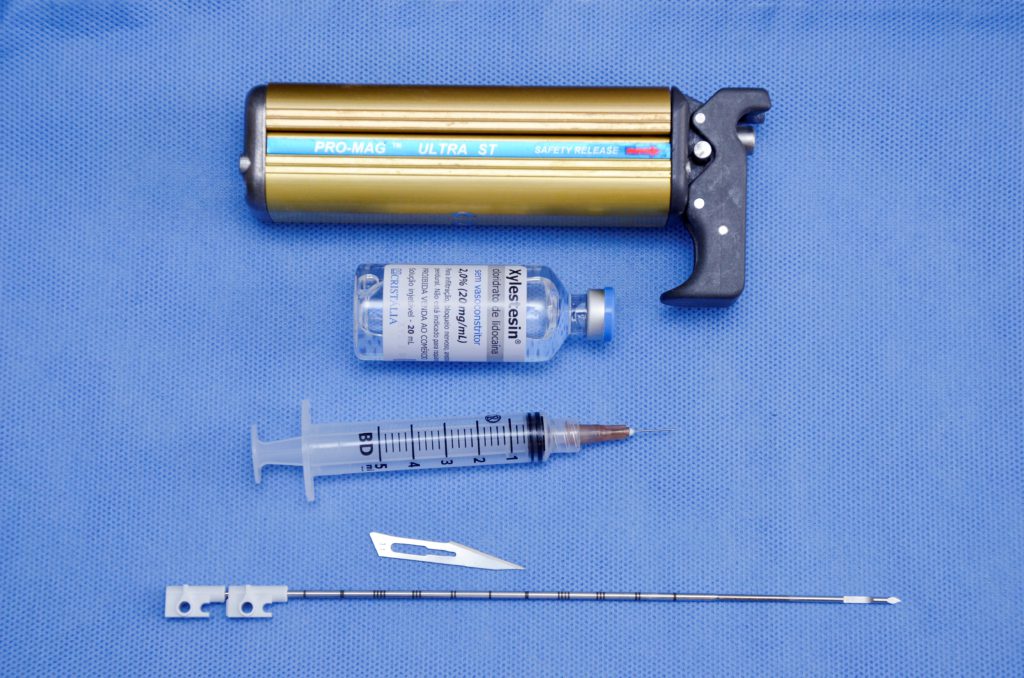
Figura 7. Biópsia por agulha grossa ou core biopsy. Dispositivo ou pistola. Agulha descartável, 12 cm e calibre 14 G. Lâmina número 11 para incisão da pele e anestésico local.
Figura 8. Biópsia por agulha grossa ou core biopsy.
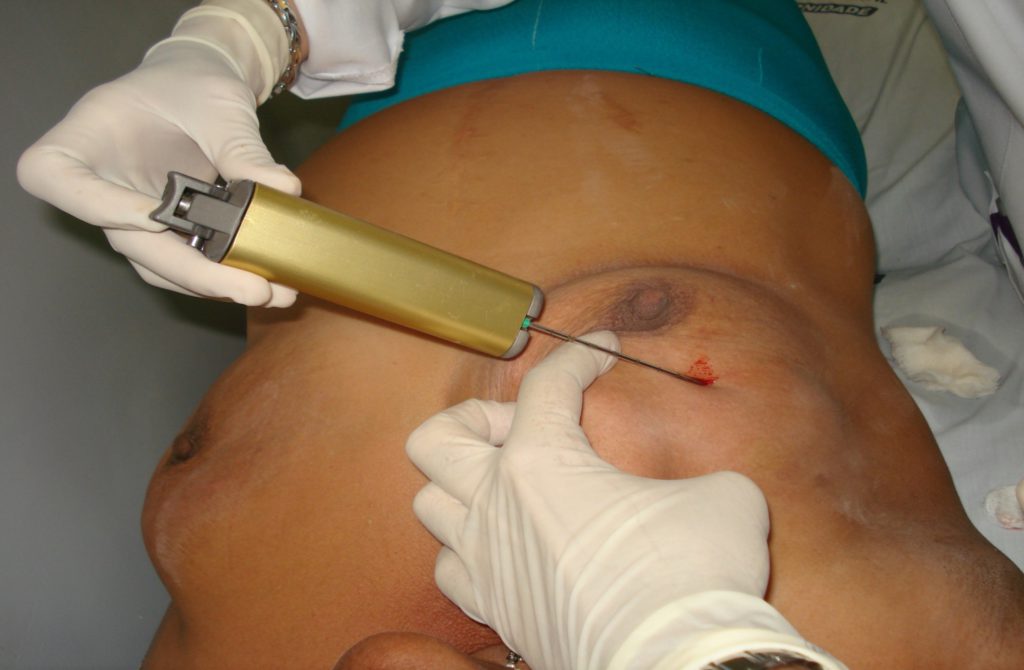
A. Mão livre.
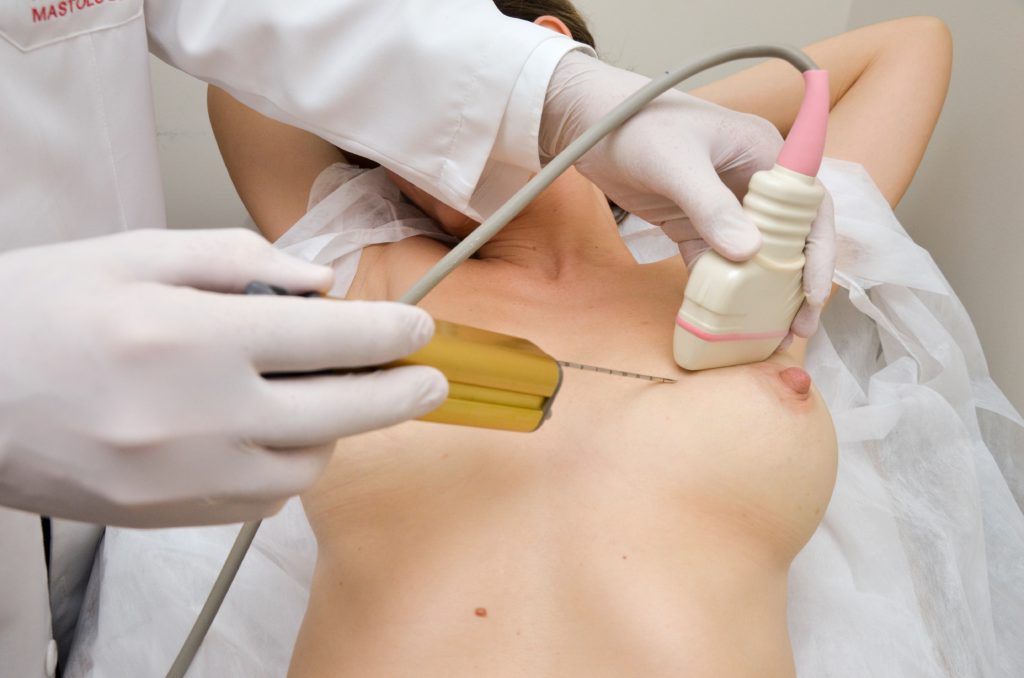
B. Guiada por ultrassonografia.
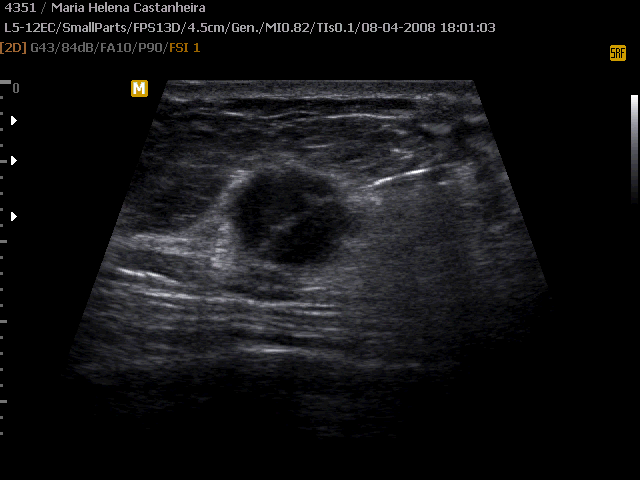
C. Ultrassonografia de core biopsy. Agulha posicionada antes do disparo.
Biópsia por PUNCH
A biópsia da pele da mama por punch é um procedimento ambulatorial realizado sob anestesia local, utilizando um cilindro cortante de 4 ou 5 mm (punch), que ao ser girado se aprofunda na pele e permite a remoção de um cone com as várias camadas da pele, incluindo epiderme, derme e tecido celular subcutâneo (Figura 9). O fragmento é fixado em formol e posteriormente processado e corado pela Hematoxilina-Eosina (HE) para diagnóstico histológico. O punch é indicado na suspeita de acometimento da pele por doenças da mama, tais como: eczema de aréola e mamilo, câncer de Paget e carcinoma inflamatório.
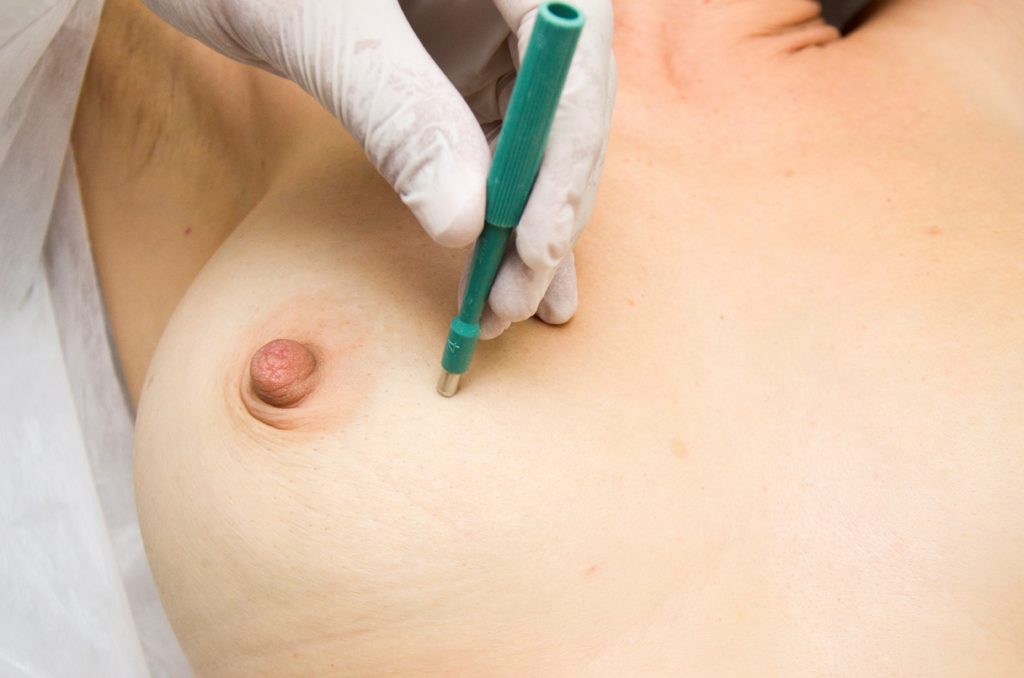
A. Biópsia de pele da mama.
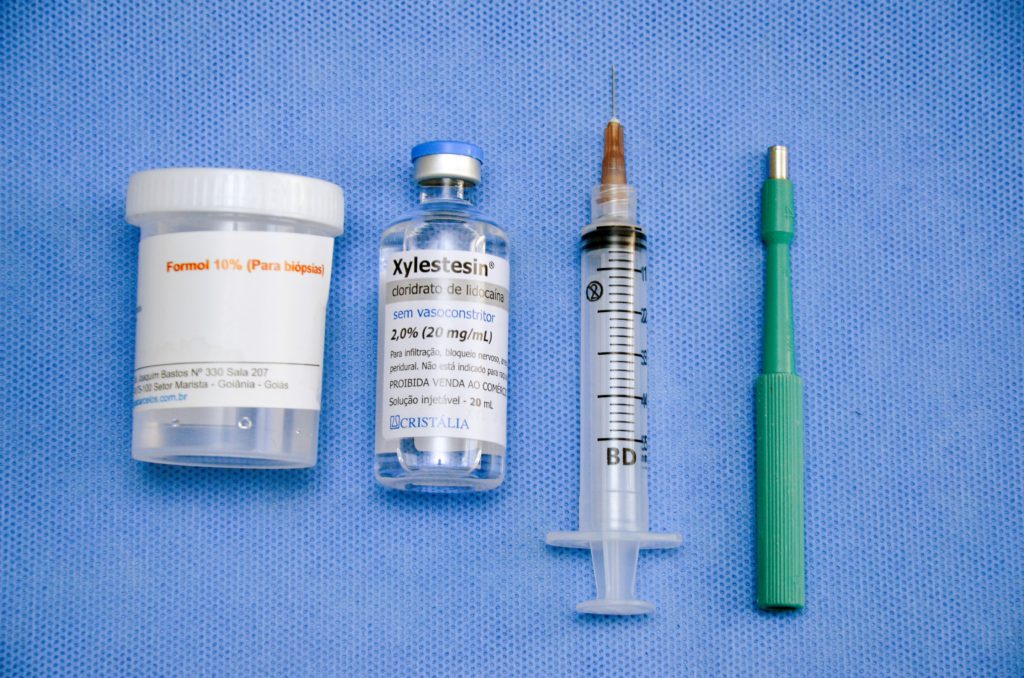
B. Punch, anestésico local e formol a 10%.
Figura 9. Biópsia por punch dermatológico
Localização pré-operatória de lesões impalpáveis
A localização pré-cirúrgica de lesão não palpável pode ser feita com fio metálico (agulhamento), marcada com carvão ativado, azul patente V, ou com tecnécio -99. O procedimento pode ser orientado por ultrassonografia, mamografia e ressonância magnética, sendo a ultrassonografia o método de escolha, pelo menor tempo de realização e maior conforto para a paciente. Classicamente, o fio guia metálico tem um sistema de gancho ou anzol que fixa a área a ser ressecada. Uma vez marcada a lesão mamária, a paciente é submetida a ressecção em ambiente cirúrgico sob anestesia adequada.
Bibliografia
American College of Radiology. Breast Imaging Reporting and Data System (BI-RADS). 4th ed. Reston, VA: American College of Radiology, 2003.
Basegio DL. Câncer de mama: abordagem multidisciplinar. Rio de Janeiro: Revinter, 1999.
Bland KI, Copeland III EM. The Breast: Comprehensive Management of Benign and Malignant Disorders. 3rd ed. St. Louis: Saunders; 2003.
Boff RA, Carli AC, Brenelli H, Brenelli FP, Carli LS, Reiriz AB, Coelho CP, Coelho GP. Compêndio de Mastologia. Abordagem multidisciplinar. Caxias do Sul: Lorigraf, 2015.
Chagas CR, Menke CH, Vieira RJS, Boff RA. Tratado de Mastologia da SBM. Rio de Janeiro: Revinter, 2011.
Franco JM. Mastologia. Formação do especialista. São Paulo: Atheneu, 1997.
Gebrim LH. Mastologia de consultório. São Paulo: Atheneu, 2012.
Girão MJBC, Baracat EC, Rodrigues de Lima G. Tratado de Ginecologia. Rio de Janeiro: Atheneu, 2017.
Harris JR, Lippman ME, Morrow M, Osborne CK. Diseases of the Breast. 3rd ed. Philadelphia, PA: Lippincott Williams & Wilkins; 2004.
Kemp C, Baracat EC, Rostagno R. Leões não palpáveis da mama diagnóstico e tratamento. Rio de Janeiro: Revinter, 2003.
Kopans DB. Breast imaging. 2nd ed. Philadelphia: Lippincott-Raven, 1998.
Liberman L, Abramson AF, Squires FB, Glassman JR, Morris EA, Deshaw DD. The breast imaging reporting and data system: positive predictive value of mammographic features and final assessment categories. AJR 1998;171:35-40.
Porto CC, Porto AL. Semiologia médica. 7ª edição. Rio de Janeiro: Guanabara Koogan, 2014.
Rosen PP. Rosen’s Breast Pathology. 3rd ed. Philadelphia, PA: Lippincott Williams & Wilkins, 2008.
Sickles EA. Periodic mammographic follow-up of probably benign lesions: results in 3,184 consecutive cases. Radiology 1991;179:463-8.
Sickles EA. Wolfe mammographic parenchymal patterns and breast cancer risk. AJR Am J Roentgenol. 2007;188(2):301-3.

